Оксид углерода CO(II) - угарный газ
Оксид углерода CO(II) или монооксид углерода - бесцветный газ, не имеющий запаха, плохо растворимый в воде.
Оксид углерода CO(II) рядовому обывателю более известен, как угарный газ, который стал причиной трагических смертей десятков тысяч людей.
В молекуле оксида углерода (II) атомы кислорода и углерода соединены тройной связью.
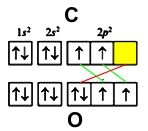
Электронные конфигурации:
- кислорода - 1s22s22p4
- углерода - 1s22s22p2
У обоих элементов имеется по два неспаренных электрона на внешнем энергетическом уровне, которые и образуют две ковалентные связи (обозначены зеленым цветом). Третья связь образуется по донорно-акцепторному принципу - атом углерода (акцептор) предоставляет свою свободную орбиталь (желтая ячейка), на которой размещается электронная пара кислорода (донор) (красный цвет).
В молекуле угарного газа атом углерода принимает валентность 3, но степень окисления +2. По этой причине, для оксида углерода CO(II) характерны реакции присоединения, в которых он играет роль восстановителя:
- на воздухе оксид углерода CO(II) горит, образуя углекислый газ:
2C+2O+O20 = 2C+4O2↑+Q - восстановительные свойства угарного газа нашли широкое применение в металлургических процессах получения металлов из их оксидов (руд):
CO+FeO = CO2↑+Fe
CO+CuO = CO2↑+Cu - в присутствии угля, который выполняет роль катализатора, на свету угарный газ взаимодействует с хлором с образованием отравляющего вещества фосген:
CO+Cl2 = COCl2
Поскольку монооксид углерода не образует солей, при н.у. угарный газ не взаимодействует с кислотами и щелочами.
В промышленных целях угарный газ получают взаимодействием углекислого газа с раскаленным углем:
CO2+C = 2CO
В лабораторных условиях CO получают действием концентрированной серной кислоты на муравьиную кислоту при высокой температуре:
HCOOH → CO↑ + H2O
Угарный газ также образуется в процессе неполного сгорания топлива:
CH4+1½O2 = CO+2H2O
Именно такие случаи приводят зачастую к непоправимым трагедиям, - люди "угорают", чаще всего в домах с печным отоплением, когда в целях сохранения тепла на ночь закрывается заслонка, препятствующая выходу продуктов горения в вытяжную трубу, но при этом дрова или уголь еще полностью не перегорели. В результате чего, образующийся угарный газ накапливается в помещении, и люди, вдыхая его во сне, умирают.
Второй, самый распространенный случай гибели людей от угарного газа - вдыхание выхлопных газов автомобиля с двигателем внутреннего сгорания в закрытом, плохо проветриваемом помещении. Сколько таких случаев было, когда водители грелись и погибали в закрытых гаражах.
Почему умирают от вдыхания угарного газа
Все дело в гемоглобине, который содержится в красных кровяных тельцах - эритроцитах. Гемоглобин - это белок, который транспортирует кислород от легких к тканям человека. Коварность угарного газа заключается в том, что CO легко преодолевает альвеолярно-капиллярную мембрану, после чего растворяется в плазме крови, и начинает "цепляться" к эритроцитам, вытесняя из гемоглобина кислород с образованием карбоксигемоглобина - в молекуле гемоглобина молекулы угарного газа соединяются с атомами железа, после чего кислород остается "не при делах". Данная реакция происходит по причине того, что монооксид углерода в 250(!) раз более активно вступает в реакцию с гемоглобином, нежели кислород. Таким образом, поступление кислорода к тканям организма нарушается, и в течение короткого времени наступает смерть человека, который задыхается "изнутри".
Концентрация угарного газа 1,2% в воздухе является смертельной - достаточно всего нескольких вдохов, чтобы человек потерял сознание, смерть наступает в течение 2-3 минут.
Оксид углерода CO2(IV) - углекислый газ
Молекула углекислого газа имеет линейное строение (углерод имеет валентность 4, и степень окисления +4):
O=C=O
Атомы углерода и кислорода связаны ковалентными полярными связями, но сама молекула неполярна.
Углекислый газ (диоксид углерода) также, как и угарный газ, не имеет цвета, запаха, плохо растворим в воде, но, растворяется лучше, чем CO. При низких температурах углекислота переходит в жидкое, а затем в твердое состояние (сухой лед).
Углекислый газ реагирует со следующими веществами:
- при растворении в воде образует угольную кислоту:
CO2+H2O = H2CO3 - с основными оксидами и основаниями CO2 взаимодействует, как кислотный оксид, образуя соли, которые называются карбонатами:
Na2O+CO2 = Na2CO3 - при высоких температурах углекислый газ проявляется свойства окислителя - активные металлы могут гореть в среде углекислого газа, отнимая у него кислород:
CO2+C = 2CO
CO2+2Mg = 2MgO+C
Получение и применение углекислого газа
- в промышленности - обжигом известняка:
CaCO3 = CaO+CO2↑ - в лаборатории - действием кислоты на соли угольной кислоты:
Na2CO3+2HCl = 2NaCl+H2O+CO2↑ - в природе углекислый газ выделяется при гниении и горении органических веществ:
C+O2 = CO2↑
Углекислый газ нашел широкое применение в пищевой промышленности, в качестве основного компонента газированных напитков. Сухой лед применяется в качестве охладителя. Углекислотные огнетушители применяются при тушении похара, если температура горения не превышает 1000°C.
