Вода (H2O)
Оксид водорода (H2O), гораздо более известный всем нам под названием "вода", без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом - в виде льда, в жикдом, собственно вода, в газообразном - в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. - это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см3;
- вода - хороший растворитель.
Строение молекулы воды
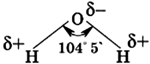
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода - положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
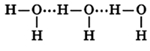
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры - чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии - образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода "охотно" вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
2Na+2H2O = 2NaOH+H2↑
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
3Fe+4H2O=FeO → Fe2O3+4H2↑ C+2H2O → CO2+2H2↑
- с основными оксидами при н.у. вода реагирует с образованием оснований:
CaO+H2O = Ca(OH)2
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
CO2+H2O = H2CO3
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества - в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества - в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества - в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды - такой "слоеный пирог" называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
CuSO4+5H2O = CuSO4·5H2O
См. далее:
