Серная кислота (H2SO4)
Молекула серной кислоты имеет крестовидную форму:
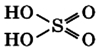
Физические свойства серной кислоты:
- плотная маслянистая жидкость без цвета и запаха;
- плотность 1,83 г/см3;
- температура плавления 10,3°C;
- температура кипения 296,2°C;
- очень гигроскопична, смешивается с водой в любых отношениях;
- при растворении концентрированной серной кислоты в воде происходит выделение большого кол-ва тепла (ВАЖНО! Приливают кислоту в воду! Воду в кислоту приливать нельзя!!!)
Серная кислота бывает двух видов:
- разбавленная H2SO4(разб) - водный раствор кислоты, в котором процентное содержание H2SO4 не превышает 70%;
- концентрированная H2SO4(конц) - водный раствор кислоты, в котором процентное содержание H2SO4 превышает 70%;
Химические свойства H2SO4
Серная кислота полностью диссоциирует в водных растворах в две ступени:
H2SO4 ↔ H++HSO4- HSO4- ↔ H++SO4-
Разбавленная серная кислота проявляет все характерные свойства сильных кислот, вступая в реакции:
- с основными оксидами:
MgO+H2SO4 = MgSO4+H2O
- с основаниями:
H2SO4+2NaOH = Na2SO4+2H2O
- с солями:
H2SO4+BaCl2 = BaSO4↓+2HCl качественная реакция на сульфат-ион: SO42-+Ba2+ = BaSO4↓
В окислительно-восстановительных реакциях серная кислота выступает в роли окислителя, при этом, в разбавленной H2SO4 роль окислителей играют катионы водорода (H+), а в концентрированной - сульфат-ионы (SO42-) (более сильные окислители, чем катионы водорода).
- разбавленная серная кислота:
H2+1S+6O4-2
окислитель H+: 2H++2e- → H20↑ - концентрированная серная кислота:
H2+1S+6O4-2
окислитель S+6:- S+6+2e- → S+4 (SO2)
- S+6+6e- → S0 (S)
- S+6+8e- → S-2 (H2S)
Разбавленная серная кислота реагирует с металлами, стоящими в электрохимическом ряду напряжений левее водорода (реакция проходит с образованием сульфатов и выделением водорода):
H2SO4(разб)+Fe = FeSO4+H2↑

С металлами, стоящими правее водорода (медь, серебро, ртуть, золото), разбавленная серная кислота не реагирует.
Концентрированная серная кислота является более сильным окислителем, особенно это проявляется при нагревании. Концентрированная серная кислота не реагирует только с золотом, с остальными металлами, стоящими правее водорода, кислота взаимодействует с образованием сульфатов и сернистого газа. Более активными металлами (цинк, алюминий, магний) концентрированная серная кислота восстанавливается до свободной серы или сероводорода.
С остальными металлами серная кислота взаимодействует с образованием сернистого газа, серы или сероводорода (конкретный продукт восстановления серной кислоты зависит от ее концентрации):
2H2SO4(конц)+Cu = CuSO4+SO2↑+2H2O 5H2SO4(конц)+4Mg = 4MgSO4+H2S↑+4H2O 4H2SO4(конц)+3Zn = 3ZnSO4+S↓+4H2O
Концентрированная серная кислота окисляет некоторые неметаллы, восстанавливаясь до сернистого газа:
2H2S+6O4(конц)+S0 = 3SO2↑+2H2O 2H2S+6O4(конц)+C = C+4O2↑+2S+4O2↑+2H2O
При низких температурах концентрированная серная кислота пассивирует некоторые металлы (железо, алюминий, никель, хром, титан), что дает возможность ее промышленной перевозки в железных цистернах.
Подробнее см. Уравнения окислительно-восстановительных реакций серной кислоты...
Получение и применение серной кислоты
Серную кислоту в промышленности получают двумя способами: контактным и нитрозным.
Контактный способ получения H2SO4:
- На первом этапе получают сернистый газ путем обжига серного колчедана:
4FeS2+11O2 = 2Fe2O3+8SO2↑
- На втором этапе, сернистый газ окисляют кислородом воздуха до серного ангидрида, реакция идет в присутствии оксида ванадия, играющего роль катализатора:
2SO2+O2 = 2SO3
- На третьем, последнем этапе, получают олеум, для этого серный ангидрид растворяют в концентрированной серной кислоте:
H2SO4+nSO3 ↔ H2SO4·nSO3
- В дальнейшем олеум транспортируется в железных цистернах, а серная кислота получается из олеума разбавлением водой:
H2SO4·nSO3+H2O → H2SO4
Нитрозный способ получения H2SO4:
- На первом этапе очищенный от пыли сернистый газ обрабатывается серной кислотой, в которой растворена нитроза (оксид азота):
SO2+H2O+N2O3 = H2SO4+2NO↑
- Выделившийся оксид азота окисляется кислородом и снова поглощается серной кислотой:
2NO+O2 = 2NO2 NO2+NO = N2O3
Применение серной кислоты:
- для осушки газов;
- в производстве других кислот, солей, щелочей и проч.;
- для получения удобрений, красителей, моющих средств;
- в органическом синтезе;
- в производстве органических веществ.
Соли серной кислоты
Поскольку серная кислота является двухосновной кислотой, она дает два вида солей: средние соли (сульфаты) и кислые соли (гидросульфаты).
Сульфаты хорошо растворяются в воде, исключение составляют CaSO4, PbSO4, BaSO4 - первые два плохо растворяются, а сульфат бария практически нерастворим. Сульфаты, в состав которых входит вода, называются купоросами (медный купорос - CuSO4·5H2O).
Отличительной особенностью солей серной кислоты является их отношение к нагреванию, например, сульфаты натрия, калия, бария устойчивы к нагреванию, не разлагаясь даже при 1000°C, в то же время, сульфаты меди, алюминия, железа разлагаются даже при незначительном нагревании с образованием оксида металла и серного ангидрида: CuSO4 = CuO+SO3.
Горькая (MgSO4·7H2O) и глауберова (Na2SO4·10H2O) соль используются в качестве слабительного средства. Сульфат кальция (CaSO4·2H2O) - при изготовлении гипсовых повязок.
