Азотная кислота (HNO3)
Строение молекулы азотной кислоты:
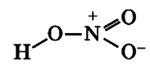
Связь N+-O- образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Физические свойства азотной кислоты:
- бесцветная маслянистая жидкость с резким запахом;
- температура кипения 83°C
- плотность 1,4 г/см3 (63% HNO3);
- с водой смешивается в любых пропорциях, проявляя в водных растворах свойства сильной кислоты;
- легко разлагается на свету при длительном хранении, приобретая при этом желтый оттенок, в который ее окрашивает газ NO2, выделяющийся при разложении:
4HNO3 ↔ 2H2O+4NO2↑+O2↑
Химические свойства азотной кислоты
HNO3 является одной из самых сильных кислот - в водных растворах полностью диссоциирует на катионы водорода и нитрат-ионы:
HNO3 ↔ H++NO3-
Азотная кислота вступает в реакции:
- с оксидами металлов:
MgO+2H+NO3 = Mg2+(NO3)2+H2O - с основаниями:
Mg(OH)2+2H+NO3 = Mg2+(NO3)2+2H2O - с солями более слабых кислот:
Na2CO32-+2H+NO3 = 2NaNO3+CO2↑+H2O
Следует обратить внимание, что азотная кислота в обменных реакциях может взаимодействовать далеко не со всеми солями, а лишь только с теми, при реагировании с которыми образуются нерастворимые, слабодиссоциирующие и газообразные вещества, которые, по мере их образования, более не участвуют в реакции обмена. В обменных реакциях солями, при взаимодействии с которыми образуются растворимые в воде соли азотной кислоты, азотная кислота не участвует.
В окислительно-восстановительных реакциях азотная кислота выступает в роли сильного окислителя. Высокие окислительные свойства HNO3 объясняются тем, что в молекуле азотной кислоты атом азота в составе кислотного остатка NO3- имеет максимально возможную степень окисления +5. По этой причине окислительные свойства NO3- значительно превосходят "возможности" катионов водорода H+, из-за чего азотная кислота реагирует практически со всеми металлами за исключением золота,платины, родия, рутения, иридия и тантала, стоящими в конце ряда напряжений.

Характерной особенностью взаимодействия азотной кислоты с металлами является отсутствие выделения водорода, поскольку окислителями являются не катионы водорода, а нитрат-ионы NO3-, которые, при взаимодействии азотной кислоты с металлами восстанавливается тем полнее, чем более активным является металл и чем более разбавленной является HNO3.
По этой причине образование тех или иных продуктов реакции азотной кислоты и металла зависит от концентрации кислоты и активности металла.
Атом азота в молекуле азотной кислоты имеет степень окисления +5, и может принимать 1, 2, 3, 4, 5 или 8 электронов:
HN+5O3+1e- → N+4O2 HN+5O3+2e- → HN+3O2 HN+5O3+3e- → N+2O HN+5O3+4e- → N2+1O HN+5O3+5e- → N20 HN+5O3+8e- → N-3H3 HN+5O3+8e- → N-3H4NO3
Чем более концентрированной является азотная кислота, тем меньшей окислительной способностью по отношению к металлам она обладает.
С другой стороны, чем более активным является металл, тем в большей степени он восстанавливает азотную кислоту.
Примеры реакций азотной кислоты:
- концентрированная HN+5O3 с активными металлами (до алюминия в ряду напряжений) восстанавливается до N2O
10HN+5O3+4Ca0 = 4Ca+2(NO3)2+N2+1O↑+5H2O - концентрированная HN+5O3 с неактивными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN+5O3+Ni0 = Ni+2(NO3)2+2N+4O2↑+2H2O - концентрированная HN+5O3 с неметаллами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN+5O3+P0 = HP+5O3+5N+4O2↑+2H2O - разбавленная HN+5O3 с активными металлами (до алюминия в ряду напряжений) образует аммиак или нитрат аммония
10HN+5O3+4Mg0 = 4Mg+2(NO3)2+N-3H4N+5O3+3H2O - разбавленная HN+5O3 с неактивными металлами образует оксид азота (II)
8HN+5O3+3Cu0 = 3Cu+2(NO3)2+2N+2O↑+4H2O - разбавленная HN+5O3 с неметаллами образует оксид азота (II)
2HN+5O3+S0 = H2S+6O4+2N+2O↑
Уравнения окислительно-восстановительных реакций азотной кислоты...
Концентрированная азотная кислота пассивирует алюминий, железо и хром, образуя на их поверхности очень прочную нерастворимую оксидную пленку:
2Al+6HNO3 = Al2O3+6NO2+3H2O
"Царская водка" (смесь концентрированной азотной кислоты с соляной в соотношении 1:3) окисляет золото и платину:
Au+3HNO3+3HCl = AuCl3+3NO2+3H2O
Получение и применение азотной кислоты
Промышленный способ получения азотной кислоты:
- окислением аммиака на платиновом катализаторе до оксида азота (II):
4N-3H3+5O20 = 4N+2O-2+6H2O - окислением оксида азота (II) до оксида азота (IV):
2N+2O-2+O20 = 2N+4O2-2 - растворением оксида азота (IV) в воде в присутствии кислорода (автор способа И.И.Андреев, 1916 г.):
4N+4O2+2H2O+O20 = 4HN+5O3-2
Лабораторный способ получения азотной кислоты:
- взаимодействием безводных нитратов с концентрированной серной кислотой:
NaNO3+H2SO4 = NaHSO4+HNO3
Применение азотной кислоты:
- производство азотных удобрений;
- в фармакологии для производства лекарственных препаратов;
- в производстве взрывчатых веществ.
Соли азотной кислоты
О солях азотной кислоты, наверняка, слышали многие, ведь в последнее время так много говорят о вреде нитратов в овощах и фруктах.
Нитраты калия, натрия, аммония и кальция называются селитрами (калийная селитра, натриевая селитра, аммонийная селитра, известковая селитра). Селитры нашли широкое применение в сельском хозяйстве в качестве минеральных азотных удобрений, что вполне логично, ибо азот является одним из основных элементов растений.
Нитраты хорошо растворяются в воде, при этом такие растворы не обладают окислительными свойствами, а вот расплавы нитратов являются хорошими окислителями.
Те нитраты, которые были образованы слабыми основаниями, гидролизуются, их водные растворы являются кислыми:
Cu2+(NO3)2+H2O ↔ CuOH+NO3+H+NO3
Соли азотной кислоты являются сильными окислителями.
Все нитраты, за исключением нитрата аммония разлагаются с выделением кислорода, при этом образующиеся продукты разложения зависят от электроотрицательности металла (см. таблицу выше):
- соли металлов, расположенных в ряду напряжений левее магния, при разложении образуют кроме кислорода еще и нитриты:
MeN+5O3 → MeN+3O2+O20↑
2KNO3 = 2KNO2+O2 - соли металлов, расположенных от магния до меди - образуют оксиды металла и азота (IV):
MeN+5O3 → MeO+N+4O2↑+O20↑
2Pb(NO3)2 = 2PbO+4NO2+O2 - соли металлов, расположенных правее меди - образуют свободный металл и оксид азота (IV):
MeN+5O3 → Me+N+4O2↑+O20↑
2AgNO3 = 2Ag+2NO2+O2 - нитрат аммония разлагается с образованием оксида азота (I) и воды:
NH4NO3 = N2O+2H2O
Нитраты вступают в реакции, типичные для всех солей:
- с металлами:
Hg(NO3)2+Zn = Zn(NO3)2+Hg - с щелочами:
Pb(NO3)2+2NaOH = Pb(OH)2↓+2NaNO3 - с кислотами:
Ba(NO3)2+H2SO4 = BaSO4↓+2HNO3 - с другими солями:
AgNO3+NaCl = AgCl↓+NaNO3
Получение и применение нитратов
Нитраты получают реакцией азотной кислоты:
- на металлы:
10HNO3(разб)+4Zn = 4Zn(NO3)2+NH4NO3+3H2O - на оксиды металлов:
2HNO3+CuO = Cu(NO3)2+H2O - на основания:
3HNO3+Al(OH)3 = Al(NO3)3+3H2O
Применение нитратов:
- Селитры используются в качестве минеральных удобрений:
- KNO3 - калийная или индийская селитра;
- NaNO3 - натриевая или чилийская селитра;
- NH4NO3 - аммонийная селитра;
- Ca(NO3)2 - известковая или норвежская селитра.
- Калийная селитра используется для изготовления "черного пороха".
- Аммонийная селитра используют для изготовления взрывчатого вещества - аммонала.
Другие соединения азота:
