Фосфорные кислоты
Разновидности фосфорных кислот:
- метафосфорные к-ты;
- ортофосфорные к-ты;
- полифосфорные к-ты.
Метафосфорная кислота
Формула простейшей метафосфорной кислоты имеет вид: HPO3 - это стекловидное твердое вещество, обладает всеми свойствами кислот.
Триметафосфорная кислота (HPO3)3 построена из трех остатков метафосфорной кислоты, которые составляют замкнутый цикл:
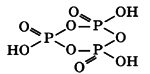
Соответственно, тетраметафосфорная кислота (HPO3)4 построена из 4 остатков метафосфорной кислоты, и получается воздействием фосфорного ангидрида P2O5(V) на воду при низких температурах:
P4O10+2H2O = (HPO3)4
Ортофосфорная кислота H3PO4
Ортофосфорная (фосфорная) кислота является трехосновной кислотой средней силы (ее соли - фосфаты или ортофосфаты).
Графическая формула H3PO4:
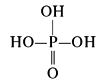
- бесцветные прозрачные кристаллы;
- температура плавления 42°C;
- неограниченно растворяется в воде, с образованием водородных связей, как между собой (высокая вязкость раствора), так и с молекулами воды (высокая растворимость).
H3PO4 диссоциирует в три ступени:
- H3PO4 ↔ H++H2PO4- (Kдис=7,5·10-3)
- H2PO4- ↔ H++HPO42- (Kдис=6,2·10-8)
- HPO42- ↔ H++PO43-(Kдис=5,0·10-13)
В водном р-ре фосфорной кислоты преобладают ионы H+ и H2PO4-, поскольку константы второй и третьей ступени диссоциации намного меньше, чем константа первой ступени.
Несмотря на тот факт, что фосфорная к-та обладает всеми свойствами общих кислот, она намного слабее, например, азотной или серной кислоты, и не обладает, в отличие от сильных кислот, сколь-нибудь значительными окислительными свойствами, что объясняется устойчивой степенью окисления фосфора (+5).
Как трехосновная кислота H3PO4 образует средние соли и два вида кислых солей, например:
- фосфат натрия - Na3PO4
- гидрофосфат натрия - Na2HPO4
- дигидрофосфат натрия - NaH2PO4
В промышленности ортофосфорную кислоту получают воздействием серной кислоты на фосфориты и апатиты (экстракционный метод):
Ca3(PO4)2+3H2SO4 = 2H3PO4+3CaSO4
Более чистая кислота получается сжиганием фосфора с последующим растворением в воде образующегося оксида P2O5.
Фосфорную кислоту применяют в производстве:
- удобрений;
- химических реактивов;
- органических веществ;
- катализаторов;
- защитных покрытий на металлах;
- в фармацевтической промышленности.
Полифосфорная кислота
Эти кислоты состоят из открытых цепей, в состав которых входят 2..10 атомов фосфора. На рисунке ниже изображена структура молекулы трифосфорной кислоты H5P3O10:
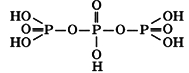
Все фосфорные кислоты получаются реакцией фосфорного ангидрида P2O5 с водой - чем больше концентрация оксида фосфора (V), тем больше образуется полифосфорной кислоты, и меньше - ортофосфорной. Примеры реакций представлены ниже:
- P2O5:H2O = 1:3 - образуется ортофосфорная кислота
P2O5+3H2O = 2H3PO4 - P2O5:H2O = 1:2 - образуется дифосфорная кислота
P2O5+2H2O = H4P2O7 - P2O5:H2O = 1:1,6 - образуется трифосфорная кислота
3P2O5+5H2O = 2H5P3O10 - P2O5:H2O = 1:1 - образуется тетраметафосфорная кислота
2P2O5+2H2O = (HPO3)4
Фосфорноватистая кислота H3PO2
Бесцветные кристаллы, хорошо растворимые в воде.
Водный раствор фосфорноватистой кислоты является сильной одноосновной кислотой:
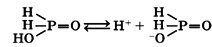
Фосфорноватистая кислота и ее соли (гипофосфиты) являются сильными восстановителями:
H3PO2+2I2+2H2O = H3PO4+4HI
Фосфористая кислота H3PO3
Твердое бесцветное вещество, обладающее гигроскопическими свойствами, хорошо растворимо в воде.
Водный раствор фосфористой кислоты является двухосновной кислотой средней силы:
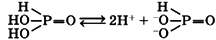
Соли фосфористой кислоты, называемые фосфитами, плохо растворимы в воде за исключением фосфитов щелочных металлов.
Фосфористая кислота и ее соли являются сильными восстановителями, восстанавливая неактивные металлы из их соединений:
2AgNO3+H3PO3+H2O = H3PO4+2Ag↓+2HNO3
Получение фосфористой кислоты:
- реакция оксида фосфора (III) с водой:
P2O3+H2O = 2H3PO3 - гидролиз тригалогенида фосфора:
PCl3+3H2O = H3PO3+3HCl
