Оксид фосфора P2O5(V)
Фосфор является очень "плодовитым" элементом, образуя много разнообразных оксидов и кислот.
Самым устойчивым является оксид фосфора P2O5(V), который называется фосфорным ангидридом.
Физические свойства фосфорного ангидрида:
- Белый порошок, не имеющий запаха;
- Молярная масса: 141,94 г/моль;
- Плотность: 2,39 г/см3;
- tпл.: 420°C(Н-форма), 569°C (О-форма)
- tкип.: возгоняется при 359°C (Н-форма)
Фосфорный ангидрид имеет несколько модификаций - одну кристаллическую и несколько полимерных.
В узлах кристаллической модификации расположены, соединенные попарно, молекулы P2O5.
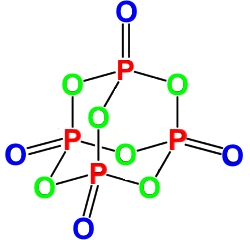
Химические свойства P2O5(V)
Фосфорный ангидрид является типичным кислотным оксидом, активно взаимодействует с водой, с образованием фосфорных кислот:
P2O5+H2O = 2HPO3 (метафосфорная к-та)
P2O5+2H2O = H4P2O7 (пирофосфорная к-та)
P2O5+3H2O = 2H3PO4 (ортофосфорная к-та)
Взаимодействие фосфорного ангидрида с основаниями и основными оксидами:
P2O5+3CaO = Ca3(PO4)2
P2O5+6NaOH = 2Na3PO4+3H2O
В реакциях со щелочами кислотный оксид P2O5(V) образует, как средние, так и кислые соли, в зависимости от соотношения реагентов:
P2O5+4NaOH = 2Na2HPO4+H2O
P2O5+2NaOH+H2O = 2NaH2PO4
Поскольку фосфорный ангидрид является водоотнимающим средством, он применяется для получения других оксидов из их кислот:
P2O5+2HNO3 = 2HPO3+N2O5
Несмотря на то, что в фосфорном ангидриде фосфор имеет максимально возможную степень окисления (+5), оксид фосфора P2O5(V) не обладает выраженными окислительными свойствами, что объясняется тем, что +5 является крайне неустойчивой степенью окисления для фосфора.
Получают P2O5(V) при горении фосфора в избытке кислорода:
4P+5O2 = 2P2O5
Выше уже было сказано, что фосфорный ангидрид является хорошим водопоглотителем, что позволяет его использовать в качестве осушителя разнообразных веществ (в эксикаторах), при проведении реакций дегидратации и проч.
Оксид фосфора P2O3(III)
Как и P2O5(V) оксид фосфора P2O3(III) имеет несколько модификаций, самая распространенная из которых имеет кристаллическую структуру - в узлах решетки располагаются спаренные молекулы P2O3 - это ядовитое вещество белого цвета, похожее на воск.
Свойства оксида P2O3(III) во многом схожи с фосфорным ангидридом (см. выше) - это кислотный оксид, образующий фосфористую кислоту (является сильным восстановителем, как и ее соли) при его растворении в воде:
P2O3+3H2O = 2H3PO3
P2O3(III) реагирует с основаниями и основными оксидами с образованием фосфитов (солей фосфористой кислоты):
P2O3+4NaOH = 2Na2HPO3+H2O
Получают оксид фосфора P2O3(III) окислением фосфора при недостатке кислорода:
4P+3O2 = 2P2O3
